This product was successfully added to cart!
品牌商品推荐
更多 >>商品详情
客户评价
| 中文名 |
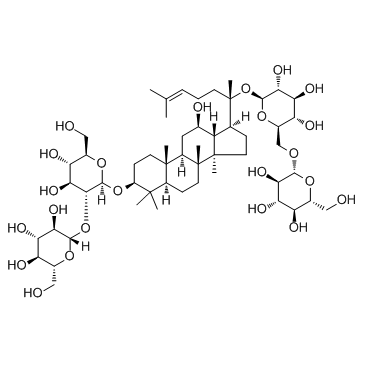
人参皂苷CK |
|---|---|
| 英文名 |
(2S,3R,4S,5S,6R)-2-[(2S)-2-[(3S,5R,8R,9R,10R,12R,13R,14R,17S)-3,12-dihydroxy-4,4,8,10,14-pentamethyl-2,3,5,6,7,9,11,12,13,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-17-yl]-6-methylhept-5-en-2-yl]oxy-6-(hydroxymethyl)oxane-3,4,5-triol |
| 中文别名 |
20(S)-人参皂苷C-K |
| 英文别名 |
更多 |
| 描述 |
Ginsenoside C-K 是一种 Ginsenoside Rb1 的细菌代谢物。Ginsenoside C-K 通过抑制诱生型一氧化氮合酶 (iNOS) 和 COX-2 来发挥抗炎作用。在人肝微粒体中,Ginsenoside C-K 抑制 CYP2C9 和 CYP2A6 活性,IC50 分别为 32.0±3.6 μM和 63.6±4.2 μM。 |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 相关类别 |
|
||||||||||||
| 靶点 |
COX-2
iNOS
CYP2C9:32 μM (IC50)
CYP2A6:63.6 μM (IC50)
|
||||||||||||
| 体外研究 |
人参皂甙CK,一种G-Rb1的细菌代谢产物,主要通过减少诱导型一氧化氮合酶(iNOS),环氧合酶(COX)-2和促炎细胞因子而表现出抗炎作用。人参皂苷CK通过下调LPS处理的小鼠腹腔巨噬细胞中IRAK-1,MAPK,IKK-α和NF-κB的活性来抑制促炎细胞因子的表达。人参皂甙CK还通过抑制LPS刺激的RAW264.7细胞中的NF-κB信号传导来抑制iNOS和COX-2的表达。在酵母多糖处理的骨髓来源的巨噬细胞(BMDM)和RAW264.7细胞中,人参皂甙CK通过负调节促炎细胞因子的分泌,MAPK的活化和ROS的产生来抑制炎症反应。此外,在LPS刺激的小胶质细胞中观察到人参皂苷CK的抗炎活性。人参皂甙CK通过控制ROS的产生和MAPKs,NF-κB和AP-1的活性来阻止炎症反应[1]。人参皂甙CK是胃肠道中人参皂甙的主要代谢产物,以PXR依赖性方式抑制NF-κB信号传导。显示人参皂甙CK通过抑制NF-κB活化促进葡聚糖硫酸钠(DSS)诱导的结肠炎的恢复。人参皂甙CK显着降低TNF-α诱导的IL-1β和iNOS mRNA水平的上调,并恢复LS174T细胞中PXR和CYP3A4的mRNA水平[2]。人参皂甙CK是20(S) – 原人参二醇衍生物的肠道代谢产物之一,对人肝微粒体中CYP2C9的活性具有抑制作用,IC50值为32.0±3.6μM,对人肝脏中CYP2A6活性的抑制作用较弱IC50值为63.6±4.2μM的微粒体,对人肝微粒体中CYP2D6活性的抑制作用更弱,IC50值超过100μM[4]。 |
||||||||||||
| 体内研究 |
在注射乳剂后第3天开始,胶原诱导的关节炎(CIA)小鼠的重量缓慢增加并且显着小于正常DBA / 1小鼠的重量。在注射乳剂后,人参皂甙CK(28,56和112mg / kg)小鼠的体重恢复d 32。与CIA小鼠相比,人参皂甙CK(56和112mg / kg)和甲氨蝶呤(MTX)处理的(2mg / kg)小鼠在d 50时显示出显着增加的体重。在免疫后第24天开始出现后爪肿胀。从第28天开始治疗CIA小鼠至第50天。从第24天开始每4天测量一次关节炎评分。人参皂苷CK(56和112mg / kg)在第51天显着降低小鼠的关节炎评分[3]。 |
||||||||||||
| 溶解度 |
体外:
在DMSO中10mM
|
||||||||||||
| 储备液 |
|
||||||||||||
| 细胞实验 |
将LS174T细胞接种在细胞成像培养皿中。孵育过夜后,用人参皂苷提取物(GSE)(100μg/ mL),Rb1(10μM)或人参皂苷CK(10μM)处理细胞3小时,然后在有或没有TNF-α的情况下进行额外孵育( 20 ng / mL)6小时。在温育结束时,收获细胞并用4%多聚甲醛溶液在20℃下固定20分钟。在PBS中洗涤后,在室温下用含0.2%Triton X-100的PBS透析细胞5分钟。在含有0.1%Triton X-100和5%牛血清白蛋白的封闭缓冲液中孵育后,将细胞与兔NF-κBp65抗体在4℃下孵育过夜,然后在室温下与Alexa Fluor 488缀合的抗兔IgG抗体孵育。在PBS中的1%牛血清白蛋白中保持30分钟。使用Zeiss 710共聚焦显微镜[2]获得荧光照片。 |
||||||||||||
| 动物实验 |
小鼠[3]使用无特定病原体的DBA / 1小鼠(雄性,18±2g)。 DBA / 1小鼠皮内注射两次,其中0.1mL该乳剂(含有100mg鸡II型胶原(CII)/小鼠)位于尾巴的背部和尾部。第一次免疫的日期定义为d 0,并且在第21天将加强注射施用于背部。在关节炎发作后,将动物随机分成5组,每个实验组由10只小鼠组成。 CIA小鼠每天一次胃内施用人参皂苷CK(28,56或112mg / kg)或免疫后第28天至第51天每3天一次MTX(2mg / kg)。正常和CIA小鼠同时给予等体积的载体(CMC-Na)[3]。 |
||||||||||||
| 存储 |
|
||||||||||||
| 运输 |
室温;可能会有所不同 |
||||||||||||
| SMILES |
C[C@@]([C@@]12C)(CC[C@@]3([H])C4(C)C)[C@@](C[C@@H](O)[C@]1([H])[C@]([C@@](CC/C=C(C)/C)(C)O[C@@H]([C@@H]([C@@H](O)[C@@H]5O)O)O[C@@H]5CO)([H])CC2)([H])[C@]3(CC[C@@H]4O)C |
||||||||||||
| 参考文献 |
|
||||||||||||
| 相关活性 小分子 |
N-乙酰对氨基酚 | n-[4-[2-乙基-1-(1H-1,2,4-噻唑-1-基)丁基]苯基]-2-苯并噻唑胺 | N’-硝基-L-精氨酸甲酯盐酸盐 | 芹菜素 | 乙酰水杨酸 | 可比司他 | 必理通 | 1400W二盐酸盐 | (20s)人参皂苷 Rg3 | N-单甲基-L-精氨酸单乙酸酯 | 黄腐酚 | 吉非罗齐 | 布洛芬 | 艾沙康唑 | 双氯芬酸 |
| 密度 | 1.2±0.1 g/cm3 |
|---|---|
| 沸点 | 723.1±60.0 °C at 760 mmHg |
| 熔点 | 178 °C |
| 分子式 | C36H62O8 |
| 分子量 | 622.873 |
| 闪点 | 391.1±32.9 °C |
| 精确质量 | 622.444458 |
| PSA | 139.84000 |
| LogP | 5.50 |
| 外观性状 | 固体;White to Light yellow powder to crystal |
| 蒸汽压 | 0.0±5.3 mmHg at 25°C |
| 折射率 | 1.572 |
| 储存条件 | 0-10°C;避免加热 |
| 危险品运输编码 | NONH for all modes of transport |
|---|
|
~83%
人参皂苷CK
39262-14-1
|
|
文献:Akao, Teruaki; Kanaoka, Matao; Kobashi, Kyoichi Biological & Pharmaceutical Bulletin, 1998 , vol. 21, # 3 p. 245 – 249 |
|
~99%

人参皂苷CK
39262-14-1
|
|
文献:Atopkina; Denisenko Chemistry of Natural Compounds, 2006 , vol. 42, # 4 p. 452 – 458 |
|
~%

人参皂苷CK
39262-14-1
|
|
文献:Atopkina, Lyubov N.; Denisenko, Vladimir A.; Uvarova, Nina I.; Elyakov, Georgi B. Carbohydrate Research, 1988 , vol. 177, p. 101 – 110 |
|
~%

人参皂苷CK
39262-14-1
|
|
文献:Atopkina, Lyubov N.; Denisenko, Vladimir A.; Uvarova, Nina I.; Elyakov, Georgi B. Carbohydrate Research, 1988 , vol. 177, p. 101 – 110 |
|
~%

人参皂苷CK
39262-14-1
|
|
文献:Atopkina, Lyubov N.; Denisenko, Vladimir A.; Uvarova, Nina I.; Elyakov, Georgi B. Carbohydrate Research, 1988 , vol. 177, p. 101 – 110 |
| 人参皂苷CK上游产品? 4 | |
|---|---|
|
|
| 人参皂苷CK下游产品? 0 | |
|
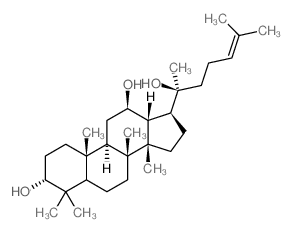
Compound K |
|
X1141 |
|
(3β,12β)-3,12-Dihydroxydammar-24-en-20-yl β-D-glucopyranoside |
|
N1890 |
|
β-D-Glucopyranoside, (3β,12β)-3,12-dihydroxydammar-24-en-20-yl |
|
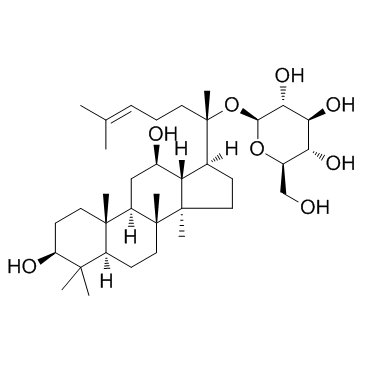
Ginsenoside K |
|
Ginsenoside C-K |