This product was successfully added to cart!
品牌商品推荐
更多 >>商品详情
客户评价
| 中文名 |
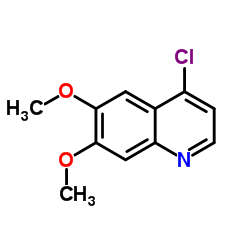
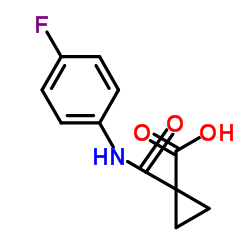
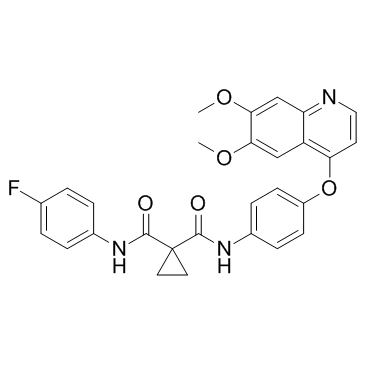
N-(4-(6,7-二甲氧基喹啉-4-基氧基)苯基)-N-(4-氟苯基)环丙烷-1,1-二羧酰胺 |
|---|---|
| 英文名 |
cabozantinib |
| 中文别名 |
博卡替尼 | 卡博替尼 | N-[4-[(6,7-二甲氧基-4-喹啉基)氧基]苯基]-N’-(4-氟苯基)-1,1-环丙烷二甲酰胺 | 卡赞替尼 |
| 英文别名 |
更多 |
| 描述 |
Cabozantinib是一种有效的多受体酪氨酸激酶抑制剂, 抑制VEGFR2,c-Met,Kit,Axl 和 Flt3 的 IC50 分别为0.035,1.3,4.6,7 和 11.3 nM。 |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 相关类别 |
|
||||||||||||
| 靶点 |
VEGFR2:0.035 nM (IC50)
Flt-1:12 nM (IC50)
Flt-4:6 nM (IC50)
FLT3:11.3 nM (IC50)
c-Met:1.3 nM (IC50)
c-Kit:4 nM (IC50)
|
||||||||||||
| 体外研究 |
Cabozantinib是MET和VEGFR2的有效抑制剂,IC50值分别为1.3和0.035 nM。 Cabozantinib也抑制MET激活激酶结构域突变Y1248H,D1246N或K1262R(分别为IC50 = 3.8,1.18和14.6nM)。卡博替尼显示出对几种激酶的强烈抑制作用,这些激酶也与肿瘤病理生理学有关,包括KIT,RET,AXL,TIE2和FLT3(分别为IC50 = 4.6,5.2,7,14.3和11.3nM)。在细胞试验中,Cabozantinib抑制MET和VEGFR2以及KIT,FLT3和AXL的磷酸化,IC50值分别为7.8,1.9,5.0,7.5和42μM。在许多人肿瘤细胞系中评估了Cabozantinib对增殖的作用。携带扩增MET的SNU-5和Hs746T细胞对Cabozantinib最敏感(IC50分别为19和9.9 nM);然而,缺乏MET扩增的SNU-1和SNU-16细胞更具抗性(IC50分别为5,223和1,149nM)。 MDA-MB-231和U87MG细胞对Cabozantinib的敏感性水平相当(IC50分别为6,421和1,851 nM),而H441,H69和PC3细胞系对Cabozantinib最不敏感,IC50值为21,700,20,200,分别为10,800 nM。此外,与野生型BaF3细胞(IC50 = 9,641 nM)相比,表达人FLT3-ITD(急性髓性白血病中的活化突变)的BaF3细胞对Cabozantinib敏感(IC50 = 15 nM)[2]。 |
||||||||||||
| 体内研究 |
Cabozantinib(XL184)后肿瘤血管分布减少,3 mg / kg时降低67%,30 mg / kg降低83%[1]。在小鼠模型中,Cabozantinib显着改变肿瘤病理学,导致肿瘤和内皮细胞增殖减少,同时增加细胞凋亡和乳腺癌,肺癌和胶质瘤肿瘤模型中肿瘤生长的剂量依赖性抑制。重要的是,用Cabozantinib治疗不会增加转移实验模型中的肺肿瘤负荷,已经观察到VEGF信号传导抑制剂不靶向MET。基于体重剂量,Cabozantinib血浆暴露在大鼠中比在小鼠中高6至10倍,这导致在大鼠中诱导肿瘤生长抑制/消退的较低剂量比在小鼠中小。卡博替尼的亚慢性给药在小鼠和大鼠中具有良好的耐受性,没有毒性迹象,这通过在治疗期间稳定和/或增加体重来确定[2]。 |
||||||||||||
| 溶解度 |
体外:
DMSO:≥30mg / mL(59.82 mM) * “≥”表示可溶,但饱和度未知。 体内:1.Cabozantinib在1.25%聚乙二醇,2.5%吐温-80和5%DMSO中制备[3]。
|
||||||||||||
| 储备液 |
|
||||||||||||
| 激酶实验 |
使用荧光素酶偶联的化学发光,33P-磷酰基转移或AlphaScreen技术测定Cabozantinib对270种人激酶的广泛组的抑制特性。使用重组人全长,谷胱甘肽S-转移酶标签或组氨酸标签融合蛋白,并且通过测量每种相应激酶在Km或低于Km的ATP浓度下肽底物聚(Glu,Tyr)的磷酸化来确定IC 50值。通过测定ATP浓度范围内的IC50值,使用AlphaScreen Assay评估激酶抑制的机制[2]。 |
||||||||||||
| 细胞实验 |
在多种人肿瘤细胞系中评估了Cabozantinib对增殖的影响,包括含有扩增的MET,SNU-1和SNU-16细胞的SNU-5和Hs746T细胞,MDA-MB-231和U87MG细胞,H441,H69,和PC3细胞系,以及BaF3细胞。将细胞在含有10%FBS的培养基中一式三份接种过夜。第二天,用连续稀释的Cabozantinib处理细胞48小时,然后使用Cell Proliferation ELISA,BrdUrd分析增殖[2]。 |
||||||||||||
| 动物实验 |
小鼠[1] C57BL / 6背景中的RIP-Tag2小鼠用作肿瘤模型。除非另有说明,否则RIP-Tag2小鼠在治疗开始时为10周龄。将Cabozantinib以5mg / mL的浓度悬浮于无菌盐水或水中,并通过管饲法每天施用7天。每天通过强饲法治疗7天的小鼠研究剂量依赖性效应:XL880(1,10,20,40或60 mg / kg),Cabozantinib(3,10,30,40或60 mg / kg)或XL999 (25,40,50,60或75 mg / kg)。在用XL880(40mg / kg)处理6小时,1,4,7或14天的小鼠中研究作用的时间过程。在用XL880(40mg / kg)处理7天的小鼠中研究戒断的影响,然后在0天,2天,7天或14天不进行治疗。每组含有4-6只小鼠。小鼠[2]使用雌性nu / nu小鼠。将H441细胞(3×106)皮内植入后腹部,当肿瘤达到约150mg时,使用下式计算肿瘤重量:(肿瘤体积=长度(mm)×宽度2(mm2)] / 2,小鼠随机分组(每组n = 5)并口服单次100mg / kg剂量的Cabozantinib或载体。在指定的时间点收集肿瘤。合并的肿瘤裂解物用抗MET进行免疫沉淀,并用抗磷酸酪氨酸MET进行Western印迹。印迹剥离后,定量总MET作为上样对照。大鼠[2]在雌性Wistar大鼠的第0天,将C6细胞(5×106)皮下接种到后腹部。当肿瘤达到约250mg(3)植入后4天),将大鼠随机分组(每组8只)并用卡博替尼或水载体口服,每日一次口服治疗12天。通过口服强饲法以2mL / kg给予卡博替尼。每日收集体重,并测量肿瘤重量每周收集两次。百分比肿瘤生长抑制/回归值表示如下:1 – [(第0天的平均治疗肿瘤重量 - 第0天的平均肿瘤重量)/(最后一天的平均载体肿瘤重量 - 第0天的平均肿瘤重量)] ×100。通过单向ANOVA进行Cabozantinib治疗的肿瘤与媒介物治疗的肿瘤相对于给药前肿瘤的统计学分析,其显着性定义为P <0.05。在最终剂量后4小时收集血液,并制备血浆以确定卡博替尼的浓度。 |
||||||||||||
| 存储 |
4°C,避光
|
||||||||||||
| 运输 |
室温;可能会有所不同 |
||||||||||||
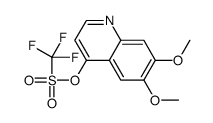
| SMILES |
O=C(C1(CC1)C(NC2=CC=C(F)C=C2)=O)NC3=CC=C(C=C3)OC4=C5C=C(OC)C(OC)=CC5=NC=C4 |
||||||||||||
| 参考文献 |
|
||||||||||||
| 相关活性 小分子 |
吡昔替尼 | 1-(6,7-二氢-5H-苯并[6,7]环庚烷并[1,2-C]哒嗪-3-基)-N3-[(7S)-6,7,8,9-四氢-7-(1-吡咯烷基)-5H-苯并环庚烯-2-基]-1H-1,2,4-三唑-3,5-二胺 | 尼达尼布 | 1,3-二氢-3-[(3,5-二甲基-1H-吡咯-2-基)亚甲基]-2H-吲哚-2-酮 | 吉瑞替尼 | 甲磺酸阿帕替尼 | 奎扎替尼 | 帕西替尼(SB1518) | N-[2-[4-(二乙氨基)丁基]氨基-6-(3,5-二甲氧基苯基)吡啶并[2,3-D-7-嘧啶基]-N’-(1,1-二甲基)脲 | 苯扎米特 | Foretinib | (2R)-1-[[5-[(Z)-[5-[[(2,6-二氯苯基)甲基]磺酰]-1,2-二氢-2-氧代-3H-吲哚-3-亚基]甲基]-2,4-二甲基-1H-吡咯-3-基]羰基]-2-(1-吡咯烷甲基)吡咯烷 | 3-四聚丙烯基二氢-2,5-呋喃二酮 | 利尼伐尼 | 西地尼布 |
| 密度 | 1.4±0.1 g/cm3 |
|---|---|
| 沸点 | 758.1±60.0 °C at 760 mmHg |
| 分子式 | C28H24FN3O5 |
| 分子量 | 501.506 |
| 闪点 | 412.3±32.9 °C |
| 精确质量 | 501.170013 |
| PSA | 98.78000 |
| LogP | 4.84 |
| 蒸汽压 | 0.0±2.6 mmHg at 25°C |
| 折射率 | 1.688 |
| 海关编码 | 2933499090 |
|---|
|
~43%
卡博替尼
849217-68-1
|
|
文献:WO2005/30140 A2, ; Page/Page column 212 ; WO 2005/030140 A2 |
|
~%

卡博替尼
849217-68-1
|
|
文献:US2012/70368 A1, ; US 20120070368 A1 US2012/252840 A1, ; US 20120252840 A1 |
|
~%

卡博替尼
849217-68-1
|
|
文献:US2012/70368 A1, ; US 20120070368 A1 US2012/252840 A1, ; US 20120252840 A1 |
|
~%

卡博替尼
849217-68-1
|
|
文献:WO2012/109510 A1, ; |
|
~%

卡博替尼
849217-68-1
|
|
文献:WO2012/109510 A1, ; |
|
~%

卡博替尼
849217-68-1
|
|
文献:US2012/252840 A1, ; US 20120252840 A1 |
|
~%

卡博替尼
849217-68-1
|
|
文献:US2012/70368 A1, ; US 20120070368 A1 US2012/252840 A1, ; US 20120252840 A1 |
|
~%

卡博替尼
849217-68-1
|
|
文献:WO2013/166296 A1, ; |
|
~%

卡博替尼
849217-68-1
|
|
文献:US2012/252840 A1, ; US 20120252840 A1 |