This product was successfully added to cart!
品牌商品推荐
更多 >>商品详情
客户评价
| 密度 | 1.7±0.1 g/cm3 |
|---|---|
| 沸点 | 119.1±30.0 °C at 760 mmHg |
| 熔点 | -22 °C |
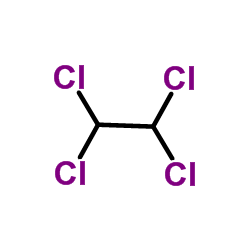
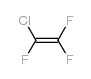
| 分子式 | C2Cl4 |
| 分子量 | 165.833 |
| 闪点 | 27.4±21.9 °C |
| 精确质量 | 163.875412 |
| LogP | 2.95 |
| 外观性状 | 无色液体带有像醚的气味 |
| 蒸汽密度 | 5.83 (vs air) |
| 蒸汽压 | 19.3±0.2 mmHg at 25°C |
| 折射率 | 1.519 |
| 储存条件 |
储存注意事项 储存于阴凉、通风的库房。远离火种、热源。包装要求密封,不可与空气接触。应与碱类、活性金属粉末、碱金属、食用化学品分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有泄漏应急处理设备和合适的收容材料。 |
| 稳定性 |
1.无色透明液体,具有类似乙醚的气味。能溶解多种物质(如橡胶、树脂、脂肪、AlCl3、S、I2、HgCl2),能溶解脂肪、油类、焦油、橡胶、天然树脂及芳香族有机酸(苯甲酸、肉桂酸、水杨酸)。大多数合成树脂在四氯乙烯中溶解或溶胀。氟树脂、环氧树脂、酚醛树脂等几乎不溶。硫、碘和氯化汞等也可溶解。与水相互溶解度很小,25℃时四氯乙烯在水中的溶解度为0.015%;水在四氯乙烯中的溶解度为0.0105%。不燃。性稳定。在无空气、湿气和催化剂存在时,加热到500℃,仍很稳定。抗水解。与乙醇、乙醚、氯仿、苯混溶。溶于约10000倍体积的水。 2.化学性质:纯净的四氯乙烯在空气中于阴暗处不被氧化,但受紫外光作用时逐渐被氧化,生成三氯乙酰氯及少量的光气。因此,工业用四氯乙烯要添加少量的酚类(对苯二酚)、胺类、醇类、腈类等作稳定剂。医药用四氯乙烯则添加少量醇类、百里酚作稳定剂。含有稳定剂的四氯乙烯在空气、水及光的存在或照射下,即使加热至140℃,对常用的金属材料也无明显的腐蚀作用。不含稳定剂的四氯乙烯,在光作用下与水长期接触时,逐渐水解成三氯代乙酸和氯化氢。四氯乙烯在无催化剂、空气和水分存在时,加热至500℃左右也是稳定的。但与空气一起通过红热管时,则热解生成一氧化碳、氯和光气。700℃与活性炭接触生成六氯乙烷和六氯苯。四氯乙烯和臭氧反应生成光气和三氯乙酰氯。同硫酸和硝酸的混合酸作用生成三氯乙酰氯和少量四氯二硝基乙烷。同浓硝酸一起加热不发生反应,与发烟硝酸作用则生成三氯乙酰氯和四氯二硝基乙烷。与二氧化氮在100℃反应生成四氯二硝基乙烷。氢化时生成四氯乙烷。在高压下与氨作用,分解成氯化铵和碳。与金属钾在其熔点附近发生爆炸性反应,与金属钠则不发生反应。经光氯化反应则生成六氯乙烷。与氟化氢及氯的混合物在氟化锆催化下,225~400℃反应,得到1,2,2-三氯-1,1,2-三氟乙烷CClF2CCl2F(氟里昂-113)。在三氯化铝存在下,与其他氯代烃发生缩合反应生成高沸点物质。 |
| 凝固点 | -22.0℃ |
| 分子结构 |
1、摩尔折射率:30.45 2、摩尔体积(cm3/mol):100.3 3、等张比容(90.2K):245.0 4、表面张力(dyne/cm):35.6 5、极化率(10-24cm3):12.07 |
| 计算化学 |
1.疏水参数计算参考值(XlogP):无 2.氢键供体数量:0 3.氢键受体数量:0 4.可旋转化学键数量:0 5.互变异构体数量:无 6.拓扑分子极性表面积0 7.重原子数量:6 8.表面电荷:0 9.复杂度:55.6 10.同位素原子数量:0 11.确定原子立构中心数量:0 12.不确定原子立构中心数量:0 13.确定化学键立构中心数量:0 14.不确定化学键立构中心数量:0 15.共价键单元数量:1 |
| 更多 |
1.性状:无色液体,有氯仿样气味。 2.熔点(℃):-22.3 3.沸点(℃):121.2 4.相对密度(水=1):1.63 5.相对蒸气密度(空气=1):5.83 6.饱和蒸气压(kPa):2.11(20℃) 7.燃烧热(kJ/mol):-679.3 8.临界温度(℃):347.1 9.临界压力(MPa):9.74 10.辛醇/水分配系数:2.6~3.4 11.溶解性:不溶于水,可混溶于乙醇、乙醚、氯仿等多数有机溶剂。 12.蒸气压(kPa,-20.6?C):0.13 13.蒸气压(kPa,2.4?C):0.67 14.蒸气压(kPa,13.8?C):1.33 15.蒸气压(kPa,121.2?C):101.33 16.黏度(mPa·s,20?C):0.880 17.蒸发热(KJ/mol,b.p.):34.75 18.生成热(KJ/mol,气体):-25.12 19.生成热(KJ/mol,液体):12.56 20.熔化热(KJ/mol):10.57 21.燃烧热(KJ/mol,25?C,液体):680.4 22.比热容(KJ/(kg·K),20?C,定压):0.904 23.电导率(S/m,20?C):5.55×10-4 24.体膨胀系数(K-1,0~25?C):0.00102 25.体膨胀系数(K-1,15~95?C):0.001079 26.常温折射率(n20):1.5053 27.常温折射率(n25):1.5028 28.溶度参数(J·cm-3)0.5:18.956 29.van der Waals面积(cm2·mol-1):8.500×109 30.van der Waals体积(cm3·mol-1):58.980 31.液相标准声称热(焓)( kJ·mol-1):-51.8 32.液相标准热熔(J·mol-1·K-1):147.0 33.气相标准声称热(焓)( kJ·mol-1) :-12.1 34.气相标准熵(J·mol-1·K-1) :340.96 35.气相标准生成自由能( kJ·mol-1):22.7 36.气相标准热熔(J·mol-1·K-1):94.90 |
2、对环境的影响 二、毒理学资料及环境行为
毒性:属中等毒类。 急性毒性:LD 503005mg/kg(大鼠经口);LC 5050427mg/m 3 4小时(大鼠吸入);人吸入13.6g/m 3,数分钟内轻度麻醉;人吸入0.7~0.8g/m 3,喉部轻度刺激和干燥感;人吸入0.5~0.54g/m 3,轻度眼刺激和烧灼感,数分钟适应;人吸入0.34g/m 3,可嗅到气味。 刺激性:家兔经眼:500mg(24小时),轻度刺激。家兔经皮:4mg,轻度刺激。 致突变性:微生物致突变:鼠伤寒沙门氏菌50ul/皿/微粒体致突变:鼠伤寒沙门氏菌200ul/皿。 生殖毒性:大鼠吸入最低中毒(TCL 0):1000ppm(24小时,孕后1~22天用药),有胚胎毒性。小鼠吸入最低中毒(TCL 0):300ppm(7小时,孕后6~15天用药),有胚胎毒性。 致癌性:IARC致癌性评论:动物为可疑性反应。 转归:释放到周围大气中的大部分四氯乙烯,由于阳光作用而分解,形成象氯化氢、三氯乙酸和二氧化碳之类的产物。地表水中的四氯乙烯迅速蒸发,在水中几乎不发生降解。该化合物在地下水中是稳定的,这正是作出由于工业溢漏和废物堆积造成地下水污染发生率增加这种考虑的原因。 危险特性:一般不会燃烧,但长时间暴露在明火及高温下仍能燃烧。受高热分解产生有毒的腐蚀性气体。与活性金属粉末(如镁、铝等)能发生反应,引起分解。若遇高热可发生剧烈分解,引起容器破裂或爆炸事故。 燃烧(分解)产物:氯化氢、光气。 3、现场应急监测方法 便携式气相色谱法;水质检测管法;气体检测管法 气体速测管(德国德尔格公司产品) 4、实验室监测方法
5、环境标准
6、应急处理处置方法
|
|
四氯乙烯毒性英文版
|
| 符号 |



GHS07, GHS08, GHS09 |
|---|---|
| 信号词 |
Warning |
| 危害声明 |
H315-H317-H319-H336-H351-H411 |
| 警示性声明 |
P273-P280-P304 + P340 + P312-P333 + P313-P337 + P313-P391 |
| 个人防护装备 |
Eyeshields;Faceshields;full-face respirator (US);Gloves;multi-purpose combination respirator cartridge (US);type ABEK (EN14387) respirator filter |
| 危害码 (欧洲) |
Xn:Harmful |
| 风险声明 (欧洲) |
R40;R51/53 |
| 安全声明 (欧洲) |
S23-S36/37-S61-S45-S24-S16-S7 |
| 危险品运输编码 | UN 1897 6.1/PG 3 |
| WGK德国 | 3 |
| RTECS号 | KX3850000 |
| 包装等级 | III |
| 危险类别 | 6.1 |
| 海关编码 | 2903230000 |
| 四氯乙烯上游产品? 9 | |
|---|---|
|
|
|
|
|
|
|
|
|
| 四氯乙烯下游产品? 10 | |
|
|
|
|
|
|
|
|
1.乙烯法本法可联产三氯乙烯和四氯乙烯,分下列二法。a)直接氯化乙烯和氯在含FeCl3催化剂的1,2-二氯乙烷溶液中,于280-450℃进行反应,生成1,2-二氯乙烷,再进一步氯化成三氯乙烯和四氯乙烯,经蒸馏后,分别用NH3中和、洗涤、干燥,即得成品。b)氧氯化法以乙烯和氯加成生成1,2-二氯乙烷,1,2-二氯乙烷与氯、氧在以CuCl2和KCl为催化剂以及425℃、138-207kPa条件下进行氧氯化反应,产物经冷却、水洗、干燥后蒸馏,得高纯度产品。
2.烃类氧化法 将含甲烷、乙烷、丙烷、丙烯等的烃类混合物于50-500℃氯化热解,得氯代烃类的混合物,精馏后分离成各种产品。
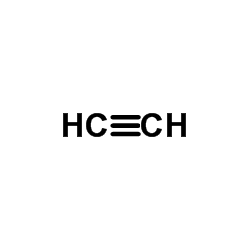
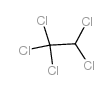
3.乙炔法乙炔和氯加热氯化生成1,1,2,2-四氯乙烷,用碱脱去氯化氢得三氯乙烯,再经氯化生成五氯乙烷,然后再用碱脱去氯化氢得四氯乙烯。因乙炔价昂,已逐步为乙烯法等代替。
4.制法 乙炔氯化后生成四氯乙烷,经碱解脱去HCl后成为三氯乙烯,再氯化则成为五氯乙烷,然后用氢氧化钙脱去HCl后即成为四氯乙烯。
为制备色谱纯四氯乙烯,可以氮气为载气,在装有SE30/白色硅