This product was successfully added to cart!
品牌商品推荐
更多 >>商品详情
客户评价
| 中文名 |
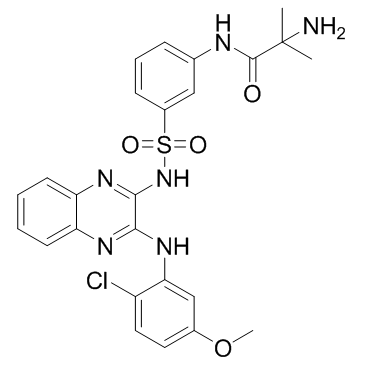
2-氨基-N-[3-[N-[3-[(2-氯-5-甲氧基苯基)氨基]喹喔啉-2-基]氨基磺酰基]苯基]-2-甲基丙酰胺 |
|---|---|
| 英文名 |
2-amino-N-[3-[[3-(2-chloro-5-methoxyanilino)quinoxalin-2-yl]sulfamoyl]phenyl]-2-methylpropanamide |
| 英文别名 |
更多 |
| 描述 |
Pilaralisib (XL147; SAR245408) 是一种有效的选择性 I 类 PI3Ks 抑制剂,抑制 PI3Kα,PI3Kβ,PI3Kγ 和 PI3Kδ,IC50 分别为 39 nM,383 nM,23 nM 和 36 nM。 |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 相关类别 |
|
||||||||||||
| 靶点 |
PI3Kα:39 nM (IC50)
PI3Kβ:383 nM (IC50)
PI3Kδ:36 nM (IC50)
PI3Kγ:23 nM (IC50)
Vps34:6974 nM (IC50)
DNA-PK:4750 nM (IC50)
|
||||||||||||
| 体外研究 |
Pilaralisib(XL147)显示出对I类PI3K同种型p110α,p110δ和p110γ的有效抑制活性,IC50分别为39,36和23 nM。 Pilaralisib(XL147)对剩余的I类同种型p110β的效力较低,IC50值为383 nM。 Pilaralisib(XL147)抑制PI3Kα的IC50值在不同浓度的ATP下测定,显示XL147是ATP竞争性抑制剂,平衡抑制常数(Ki)值为42 nM。 Pilaralisib(XL147)对III类PI3K液泡分选蛋白34(VPS34; IC50值~7.0M)和PI3K相关DNA依赖性蛋白激酶(DNA-PK; IC50值4.75μM)具有相对弱的抑制活性。在使用细胞裂解物的mTOR激酶免疫沉淀测定中,Pilaralisib(XL147)不抑制针对生理底物蛋白真核翻译起始因子4E结合蛋白1(4EBP1; IC50>15μM)的mTOR活性。与其对纯化的PI3K蛋白的抑制活性一致,Pilaralisib(XL147)在无血清培养基中抑制EGF诱导的PC-3和MCF7细胞中PIP3的产生,IC50分别为220和347nM。 Pilaralisib(XL147)抑制PI3K下游关键信号蛋白磷酸化的能力通过评估其对EGF刺激的AKT磷酸化的影响以及基于细胞的无血清培养基中PC-3细胞中S6的非刺激磷酸化来检测ELISA。 Pilaralisib(XL147)抑制这些活性,IC50分别为477和776 nM [1]。 |
||||||||||||
| 体内研究 |
在10,30,100或300mg / kg的单次口服剂量后,检查Pilaralisib(XL147)抑制AKT,p70S6K和S6的这种内源性磷酸化的能力。在给药后4,24或48小时收获肿瘤并在裂解缓冲液中匀浆。然后合并来自每只动物(n = 4)的肿瘤裂解物,并通过Western免疫印迹分析总的和磷酸化的AKT,p70S6K和S6的水平。 Pilaralisib(XL147)的施用引起肿瘤中AKT,p70S6K和S6磷酸化的剂量依赖性降低,在4小时时达到最大81%的AKT磷酸化抑制,300mg / kg。来自4小时时间点的剂量 – 反应关系预测在约100 mg / kg(pAKTT308),54 mg / kg(pAKTS473),71 mg / kg剂量的剂量下,AKT,p70S6K和S6磷酸化的50%抑制( p-p70S6K)和103mg / kg(pS6)。在100mg / kg剂量的Pilaralisib(XL147)后,MCF7肿瘤中AKT,p70S6K和S6磷酸化的抑制在4小时时最大,达到55%至75%;然而,在24小时内抑制水平降低至8%至45%,并且在48小时内仅有极小或没有抑制作用。在300mg / kg剂量的Pilaralisib(XL147)后,抑制在4小时时也是最大的(65%-81%)。然而,与100 mg / kg剂量相比,24小时(51%-78%)的抑制几乎与4小时时的抑制相当,并且部分抑制(25%-51%)持续48小时[1] 。 |
||||||||||||
| 溶解度 |
体外:
DMSO:6 mg / mL(11.09 mM;需要超声波和加热)
|
||||||||||||
| 储备液 |
|
||||||||||||
| 细胞实验 |
将MCF7人乳腺癌细胞和PC-3人前列腺腺癌细胞维持在37℃,5%CO 2的培养条件下。对于EGF处理后的PI3K途径状态评估,将培养基替换为溶解在含有0.3%DMSO的无血清DMEM中的测试化合物。温育3小时后,用100ng / mL EGF刺激细胞10分钟,并进行细胞裂解物的Western免疫印迹分析。进行Ramos细胞中mTOR途径状态的评估。使用Cell Proliferation ELISA,bromodeoxyuridine(BrdUrd)化学发光试剂盒评估细胞增殖。进行细胞毒性,细胞凋亡(半胱天冬酶-3/7),不依赖贴壁的生长和PC-3细胞迁移测定。评估肝细胞生长因子(HGF)诱导的趋化性。进行内皮细胞管形成测定,稍作修改。使用Image Pro Plus软件[1]量化总管长度。 |
||||||||||||
| 动物实验 |
小鼠[1]使用雌性无胸腺裸鼠和雄性裸鼠。培养肿瘤细胞并在小鼠中建立为异种移植物,并评估体重和肿瘤重量。使用双尾学生t检验确定统计学显着性(显着性定义为P <0.05)。将Pilaralisib(XL147)配制在无菌水/ 10mmol / L HCl或水中,并以指定剂量和方案通过口服管饲法以10mL / kg的剂量体积施用。 |
||||||||||||
| 存储 |
|
||||||||||||
| 运输 |
室温;可能会有所不同 |
||||||||||||
| SMILES |
CC(C)(N)C(NC1=CC=CC(S(=O)(NC2=NC3=CC=CC=C3N=C2NC4=CC(OC)=CC=C4Cl)=O)=C1)=O |
||||||||||||
| 参考文献 |
|
||||||||||||
| 相关活性 小分子 |
6-氨基-3-甲基嘌呤 | 2-吗啉代-8-苯基色酮 | 渥曼青霉素 | (2S)-N1-[4-甲基-5-[2-(2,2,2-三氟-1,1-二甲基乙基)-4-吡啶]-2-噻唑]-1,2-吡咯烷二羧酰胺 | 5-[2,6-二(4-吗啉基)-4-嘧啶基]-4-(三氟甲基)-2-吡啶胺 | IPI549 | 2-氨基-N-[2,3-二氢-7-甲氧基-8-[3-(4-吗啉基)丙氧基]咪唑并[1,2-c]喹唑啉-5-基]-5-嘧啶甲酰胺 | 艾代拉利司 | Dactolisib | 槲皮素 | SAR405 | 2-(1H-吲唑-4-基)-6-[[4-(甲基磺酰基)-1-哌嗪基]甲基]-4-(4-吗啉基)噻吩并[3,2-D]嘧啶 | 740 YP | LY3023414 | 1,3-二咖啡酰奎宁酸 |
| 分子式 | C25H25ClN6O4S |
|---|---|
| 分子量 | 541.02200 |
| 精确质量 | 540.13500 |
| PSA | 166.66000 |
| LogP | 5.78640 |
|
~%
Pilaralisib
934526-89-3
|
|
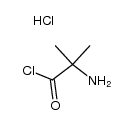
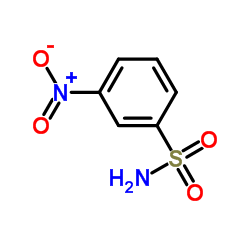
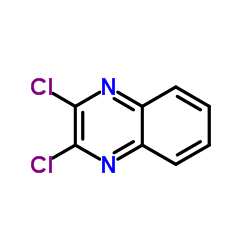
文献:SANOFI; BAILLON, Bruno; BAULIER, Virginie; COMTE, Myriam; FUGIER, Matthieu; KOZLOVIC, Stéphane; PERRIN, Marc-Antoine Patent: WO2014/41144 A1, 2014 ; Location in patent: Paragraph 00172; 00173; 00174 ; |
|
~%

Pilaralisib
934526-89-3
|
|
文献:SANOFI; BAILLON, Bruno; BAULIER, Virginie; COMTE, Myriam; FUGIER, Matthieu; KOZLOVIC, Stéphane; PERRIN, Marc-Antoine Patent: WO2014/41144 A1, 2014 ; |
|
~%

Pilaralisib
934526-89-3
|
|
文献:SANOFI; BAILLON, Bruno; BAULIER, Virginie; COMTE, Myriam; FUGIER, Matthieu; KOZLOVIC, Stéphane; PERRIN, Marc-Antoine Patent: WO2014/41144 A1, 2014 ; |
|
~%

Pilaralisib
934526-89-3
|
|
文献:SANOFI; BAILLON, Bruno; BAULIER, Virginie; COMTE, Myriam; FUGIER, Matthieu; KOZLOVIC, Stéphane; PERRIN, Marc-Antoine Patent: WO2014/41144 A1, 2014 ; |
|
unii-60es45ktmk |
|
pilaralisib |
|
XL 147 |
|
XL-147 |











![3-amino-N-{3-[(2-chloro-5-methoxyphenyl)amino]quinoxalin-2-yl}benzenesulfonamide hydrochloride结构式](https://www.chemsrc.com/caspic/260/1433222-74-2.png)